شیمی
مجموعه عملیاتی که تحت شرایط مشخص میان نشاندهی یک دستگاه یا سیستم اندازهگیری یا مقدار یک سنجه مادی یا ماده مرجع و مقدار متناظر آن که از استانداردهای اندازهگیری حاصل میشود، رابطهای برقرار میکند.
کالیبراسیون اجازه میدهد که میزان تصحیح لازم را نسبت به نشاندهی تعیین کنیم. با کالیبراسیون ممکن است خواص اندازه شناختی دیگری نظیر اثر کمیتهای تاثیر گذار نیز تعیین شود. در واقع کالیبراسیون ویژگیهای کارآمدی دستگاه یا مواد مرجع را بوسیله انجام مقایسات مستقیم مشخص میکند.
کالیبراسیون در واقع ایجاد نظامی موثر به منظور کنترل صحت و دقت پارامترهای مترولوژیکی دستگاههای آزمون و وسایل اندازهگیری و کلیه تجهیزاتی است که عملکرد آنها بر کیفیت فرایند تاثیر گذار میباشد که به منظور اطمینان از تطابق اندازهگیریهای انجام شده با استانداردهای جهانی مورد استفاده قرار میگیرد.
کدام دستگاهها باید کالیبره شوند؟
هر وسیلهای که برای اندازهگیری به کار میرود و در روشهای اجرایی به استفاده از آن اشاره شده است، نیاز به تعیین صحت و دقت یا کالیبراسیون دارد.
دستگاههای اندازهگیری باید به طور دورهای کالیبره شوند. گذشت زمان، فرسودگی، حوادث غیر قابل پیشبینی، باعث میشوند تا قابلیت ردیابی نتایج آنها تا استانداردها زیر سوال رفته و نیازمند تایید مجدد باشند. برای تجهیزات کالیبره شده گواهی کالیبراسیون صادر شده و ضمیمه دستگاه میگردد.
کالیبره کردن تمام تجهیزات لازم نیست. برخی از آنها ممکن است صرفاً به عنوان نشان دهنده مورد استفاده قرار گیرند. انواع دیگر تجهیزات ممکن است به عنوان ابزار تشخیصی و آشکارسازی به کار بروند. هر گاه وسیلهای برای تعیین قابلیت پذیرش محصول و یا عوامل موثر در فرایند آزمون مورد استفاده قرار نگیرد کالیبراسیون آن ضرورت ندارد.
اهداف اصلی کالیبراسیون
1- برای اطمینان از قرائتهایی که از دستگاه صورت میگیرد.
2- برای تعیین درستی مقادیر خوانده شده از دستگاه.
3- برای استقرار قابلیت ردیابی دستگاه به استانداردهای مرجع (هدف نهایی کالیبراسیون برقراری قابلیت ردیابی عنوان شده است.)
قابلیت ردیابی (Traceability)
مهمترین ویژگی که یک اندازهگیری باید داشته باشد وجود قابلیت ردیابی نتایج آن تا استانداردهای ملی و سپس بین المللی میباشد.
وقتی سطح اطمینان و عدم قطعیت کلیه اندازهگیریها بیان شود درستی و دقت نتایج اندازهگیری تضمین میگردد.
قابلیت ردیابی قابلیت ارتباط دادن مقدار یک استاندارد یا نتیجه یک اندازهگیری با مرجعهای ملی یا بینالمللی از طریق زنجیره پیوسته مقایسهها که همگی عدم قطعیتی معین دارند. کالیبراسیون تنها راه برقراری قابلیت ردیابی میباشد.
دستاوردهای کالیبراسیون
• به دست آوردن نتایج درست و صحیح در اندازهگیری؛
• کاهش هزینه و دوباره کاری؛
• بهرهوری بیشتر؛
• جوابگویی در دعاوی حقیقی و حقوقی؛
• یکی از نیازهای اخذ گواهیهای استانداردهای مدیریت؛
• جلوگیری از تضییع حقوق مصرف کننده و تولید کننده؛
مراحل انجام کالیبراسیون
1. کد گذاری تجهیزات اندازهگیری و تهیه شناسنامه و لیست آنها؛
2. طبقهبندی تجهیزات اندازهگیری از نظر کالیبراسیون؛
3. تعیین دوره تناوب کالیبراسیون؛
4. تعیین حد مجاز خطا؛
5. انتخاب کالیبره کننده؛
6. کالیبراسیون (عملیات کالیبراسیون، تعیین خطای تجهیز، صدور گواهی و برچسب کالیبراسیون، نصب برچسب کالیبراسیون)؛
7. اعمال نتایج کالیبراسیون؛
8. ثبت و حفظ و نگهداری سوابق کالیبراسیون.
برچسبها: کالیبراسیون چیست, کالیبراسیون, calibration
الکترونگاتیوی الکترونگاتیویته Electronegativity میزان توانایی نسبی یک اتم در یک مولکول برای جذب جفت الکترون پیوندی بسوی خود است.
الکترونگاتیوی اتمها
اتم وقتی در لایه ظرفیت خود الکترون کمتری داشته باشد تمایلش به گرفتن و یا دادن الکترون بیشتر میشود. هرچه عنصری تمایل بیشتری به گرفتن الکترون داشته باشد الکترونگاتیوتر است.
اگرچه الکترونگاتیویته، قطبیت پیوندهای شیمیایی بین اتمهای یک مولکول را تعیین میکند اما عامل تعیین کننده قطبیت کلی مولکول نیست چون مولکول میتواند دارای مرکز تقارن باشد. در این حالت قطبیت پیوندها نسبت به هم به گونهای خنثی میشود که قطبیت کلی مولکول را صفر در نظر میگیرند. بنابراین در مولکول هایی که فاقد مرکز تقارن مولکولی هستند میتوان قطبیت کلی مولکول را با تعیین جهت بردار ممان دو قطبی در آنها نتیجه گرفت.
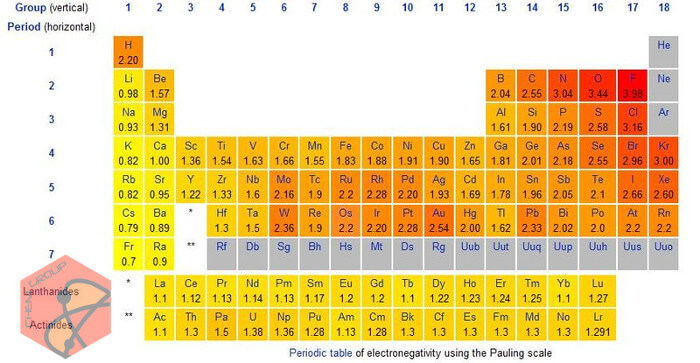
نسبی بودن الکترونگاتیوی
الکترونگاتیوی بایک مقیاس نسبی سنجیده میشود. دراین مقیاس برای اجتناب از درج اعداد منفی، به اتم فلوئور به عنوان الکترونگاتیوترین عنصر، الکترونگاتیوی ۴ نسبت داده شده است و مقادیر الکترونگاتیوی برای عنصرهای دیگر نسبت به این مقدار محاسبه میشود. در این محاسبات، گازهای نجیب را در نظر نمیگیرند، زیرا این عناصر به تعداد کافی ترکیبهای شیمیایی تشکیل نمیدهند. به طور کلی مقادیر الکترونگاتیوی در یک گروه از عناصراز بالا به پایین کاهش و در یک دوره از جدول تناوبی از چپ به راست افزایش مییابد. بنابراین کمترین مقدار الکترونگاتیوی را میتوان سزیم در پایین و سمت چپ جدول و بیشترین مقدار الکترونگاتیوی (با چشم پوشی از گازهای نجیب) را به اتم فلوئور در بالا و سمت راست جدول نسبت داد.
متداولترین مقیاس الکترونگاتیویته
مقیاس نسبی الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی б+ و б- اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق б و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد. در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد ۴ نسبت داده شده است.
مقیاس الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوند است. مثلا انرژی پیوند Br-Br ، انرژی لازم برای تفکیک مولکول Br2 به اتمهای Br است. برای تفکیک یک مول از مولکولهای Br2 به اندازه ۴۶+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر ۱۰۴+ کیلو کالری بر مول است.
تعاریف مختلف الکترونگاتیویته
الکترونگاتیویته ، در روشهای متفاوتی تعریف شده است که برخی از آنها به اختصار توضیح داده میشود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B میتواند به حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B بطور قابل ملاحظه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد، میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد
الکترونگاتیویته آلرد_روکر در این تعریف ، الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس میکند. بر طبق این تعریف ، عناصری با الکترونگاتیویته بالا آنهایی هستند که با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک ، این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توزیع دوباره الکترون در طی تشکیل تر کیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
اگر یک اتم دارای انرژی یونیزاسیون بالا و الکترونخواهی بالا باشد، احتمالا در هنگام تشکیل پیوند ، الکترونها را به سوی خود میکشد. بنابراین بعنوان الکترونگاتیو شناخته میشود. از طرف دیگر اگر انرژی یونش و الکترونخواهی آن ، هر دو کوچک باشد تمایل دارد تا الکترون از دست بدهد. بنابراین به عنوان الکترو پوزیتیو طبقه بندی میشود.
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی میکند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و همچنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد. فلزات ، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آنها حاکم است، ولی نافلزات ، به استثنای گازهای نجیب ، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آنها زیاد است.
بطور کلی ، الکترونگاتیوی عناصر در هر دوره از چپ به راست (با افزایش تعداد الکترونهای والانس) و در هر گروه از پایین به بالا (با کاهش اندازه اتم) افزایش مییابد. بنابراین ، الکترونگاتیوترین عناصر ، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات ، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی همجهت است.
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است، ولی دقیق نیست. روشی ساده و مستقم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روشهای گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتمهای متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم نامتغیر نیست.
انتظار میرود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از اینرو ، این مفهوم را تنها بایستی نیمهکمی تلقی کرد. بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی میشود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آنها خیلی زیاد نباشد. در اینگونه موارد، اختلاف الکترونگاتیوی عناصر نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است. اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند اساسا غیر قطبی است و اتمهای مربوط ، سهم مساوی یا تقریبا مساوی در الکترونهای پیوند دارند.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که HF قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل میشود، پیوند فلزی و در آن اختلاف الکترونگاتیوی نسبتا کم است.
کاربردهای الکترونگاتیویته
میتوان برای تعیین میزان واکنش پذیری فلزات و غیر فلزات بکار برد.
میتوان برای پیشبینی خصلت پیوندهای یک ترکیب بکار برد. هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود ۱٫۷ باشد، خصلت یونی نسبی پیوند بیش از ۵۰% است.
اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها ، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر ۲٫۱ است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد. بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
منابع:
برچسبها: الکترونگاتیوی, الکترونگاتیویته پاولینگ, مقیاس الکترونگاتیویته, الکترونگاتیوی اتمها
پس از چندین دهه تحقیق در سطح تئوریک، محققان موفق به کشف و ایجاد شکل جدیدی از هیدروژن شدند که پیش از این هرگز مشاهده نشده بود.
هیدروژن یکی از فراوانترین عناصر در جهان است و بیشتر سیارات عظیمالجثه منظومه شمسی از جمله خورشید از این ماده تشکیل شدهاند. همچنین تصور میشود که این ماده در هسته درونی مشتری و زحل در فشار بسیار بالا یافت شود و تشکیل همین شکل از هیدروژن است که به عنوان هدف نهایی این تحقیق قرار گرفته است.

در این تحقیق، دانشمندان موفق به ایجاد شکل فلزی و اتمی هیدروژن در فشار بیش از سه میلیون برابر فشار اتمسفر زمین شدند. ۳۰ سال آزمایش برای اثبات این تئوری که سابقه آن حتی به قبلتر از این زمان یعنی ۸۰ سال پیش باز میگردد، تا پیش از این به شکست منتهی شده بود.
فیزیکدانان دانشگاه ادینبورگ از یک جفت الماس به منظور فشردهسازی مولکولهای هیدروژن استفاده کردند تا به بررسی رفتار این مولکولها بپردازند. از الماس به منظور اعمال فشار بیشتر از ۳٫۵ میلیون اتمسفر استفاده و دما تا ۴۷۵ کلوین افزایش داده شد.
تحت این شرایط هیدروژن وارد فاز جامد جدیدی میشود که به نام فاز V نامگذاری شده است. در این وضعیت هیدروژن شروع به نشان دادن برخی خصوصیات جالب میکند. این مولکولها شروع به جدا شدن کرده و به اتمهای منفرد تبدیل میشوند، در حالی که الکترونهای این اتمها رفتاری شبیه به الکترونهای عناصر فلزی از خود نشان میدهند.
محققان میگویند که فاز تازه کشف شده تنها آغازی بر فرایند جداسازی مولکولی است و بر این باورند که هنوز فشارهای بالاتری برای ایجاد وضعیتهای خالص اتمی و فلزی که در تئوری پیشبینی شده مورد نیاز است.
این مطالعه در مجله Nature به چاپ رسیده است.
برچسبها: هیدروژن, حالت جدیدی هیدروژن
محققان با استفاده از نانوزیست مهندسی موفق به طراحی و ساخت یک ماده زیستی شبه ویروس شدند که تشکیل هیدروژن را به صورت ارزان و تمیز کاتالیز میکند. این ویروس مهندسی شده قادر است با هزینه کم، انرژی تولید کند.

محققان دانشگاه ایندیانا یک ماده زیستی شبه ویروس ساختند که تشکیل هیدروژن را بهصورت ارزان و تمیز کاتالیز میکند. این ماده زیستی با قرار دادن یک آنزیم اصلاح شده درون پوسته پروتئینی حفاظت کننده یک ویروس که کپسید نامیده میشود، تولید میشود. این کاتالیست «نانوراکتور» ۱۵۰ برابر کارآمدتر از نوع بدون تغییر یافته آنزیم است.
داگلاس شیمیدان دانشگاه ایندیانا میگوید: « در حقیقت، ما از توانایی ویروس برای خودآرایی دهها هزار واحد ساختمانی ژنتیک استفاده کردیم و همچنین از یک آنزیم بسیار حساس و شکننده با خصوصیت قابل ملاحظه جذب پروتونها و خارجسازی گاز هیدروژن بهره بردیم. نتیجه کار یک ذره شبه ویروس است که مشابه یک ماده بسیار پیچیده، تولید هیدروژن را کاتالیز میکند.»
برای تولید این زیستماده که با عنوان P22-Hyd شناخته میشود، تیم تحقیقاتی دو ژن از باکتری اشرییا کلی انتخاب کردند. این ژنها (hyaA و hyaB) زیرواحدهای کلیدی آنزیم هیدروژناز را رمزنگاری میکنند. در ادامه آنزیم درون کپسید حفاظتی یک ویروس باکتریایی (bacteriophage P22) تزریق میشود. استفاده از سیستم اتصال هیدروژناز و یک پوسته ویروس تنها به دلیل کارآمدتر بودن در کاتالیز تولید هیدروژن نیست، بلکه سادگی تولید چنین سیستمی (که تنها نیازمند یک فرآیند تخمیر ساده است)، نیز یکی دیگر از علتهای استفاده از این سیستم است. همچنین در مقایسه با دیگر کاتالیستها همچون پلاتین، این سیستم ارزانقیمت و سازگار با محیط زیست است.
داگلاس میافزاید: «این ماده قابل مقایسه با پلاتین است، ضمن اینکه کاملاً قابل تجدید است. شما برای تهیه آن نیاز به حفر معدن و استخراج آن ندارید، شما میتوانید آن را در دمای اتاق در مقیاس بزرگ توسط یک فناوری تخمیر تهیه کنید این ماده زیست تخریبپذیر است. این روش یک روش کاملاً سبز برای ساخت یک ماده بسیار با ارزش است.»
علاوه بر شکستن پیوندهای شیمیایی آب برای تولید هیدروژن، P22-Hyd همچنین واکنش ترکیب هیدروژن و اکسیژن برای تولید انرژی را نیز کاتالیز میکند.
محققان از یک فرم هیدروژناز (NiFe، نیتروژن-آهن) استفاده کردند که به راحتی با مواد زیستی ادغام میشود. آنزیم در فرم تغییر یافته و محافظت شده در مقایسه با فرم بدون تغییر آنزیم به دلیل پایداری بیشتر در برابر حرارت و مواد شیمیایی موجود در محیط، بسیار قویتر است.
داگلاس میگوید: «تاکنون هیچکس موفق به تولید مقدار کافی از این آنزیم برای تولید سوخت زیستی نشده است اما اکنون ما روشی را ابداع کردهایم که با استفاده از آن قادر به تولید مقادیر بالای مواد هستیم.»
نتایج این تحقیق در Nature Chemistry چاپ شده است.
برچسبها: ویروسی, نانوراکتور, هیدروژن
محققان روش جدیدی برای تبدیل گاز دی اکسید کربن به یک سوخت ساده و پاک معرفی کردهاند.
گروهی از محققان چینی ماده جدیدی تولید کردهاند که میتواند گاز دی اکسید کربن را به سوخت ساده و پاکی که formate نام گرفته تبدیل کند. در این پروسه از فرآیند کاهش الکتریکی استفاده میشود و به هیچ چیز به جز جریان متوسط برق نیاز ندارد.
ماده جدید یک مخلوط چهار اتمی از فلز کبالت و مولکولهای کبالت-اکسیژن است.
چندین دهه است که محققان به دنبال مادهای هستند که بتواند به طور الکتریکی دی اکسید کربن را کاتالیز کرده و به سوختهای مختلف تبدیل کند، اما این مواد همگی یک مشکل مشابه داشتهاند که درست کردن آنها را در آزمایشگاه غیرممکن میکرد.
روش کار این ماده در سطح مولکولی نسبتا ساده است. وقتی جریان الکتریکی برقرار میشود، این ماده با مولکولهای دی اکسید کربن که از خلال آن عبور میکنند واکنش میدهد. یک اتم هیدروژن که دارای یک الکترون و یک پروتون است، به اتم کربن مولکول دی اکسید کربن متصل میشود. وقتی این امر رخ میدهد یک الکترون اضافی به اتمهای اکسیژن در دی اکسید کربن متصل میشود و به این ترتیب CO2 به CHOO یا formate تبدیل میشود.
هم اکنون محققان به دنبال تجاریسازی این ماده جدید هستند که میتواند CO2 جمعآوری شده از نیروگاههای برق را به سوخت مناسب و پاک تبدیل کند.
محققان میگویند مطمئنا قبل از این که این فرآیند در قالب تجاری وارد چرخه عمل شود، سالها باید مورد بررسی و تحقیق قرار گیرد، اما در این مرحله که امکانپذیر بودن این پروسه به اثبات رسیده میتوان آن را پیشرفت بسیار مثبتی ارزیابی کرد.
محققان در این باره بسیار خوشبینانه هستند و میگویند ۱۰ سال پیش این که دی اکسید کربن بتواند به ماده سوختی قابل استفادهای تبدیل شود غیر ممکن به نظر میرسید، اما حالا به نظر میرسد که این فرایند عملی شده و در آینده میتواند در کاهش گرمایش جهانی تا حدودی موثر باشد.
این مقاله به تازگی در مجله Nature به چاپ رسیده است.
برچسبها: گاز دی اکسید کربن, سوخت پاک, ماده جدید
محققان با استفاده از نانوورقهای نیترید بور اقدام به تولید آئروژلی کردند که از آن میتوان برای زدایش نفت و حلالهای آلی از آب استفاده کرد.
محققان دانشگاه درکسل با همکاری پژوهشگران استرالیایی دانشگاه دکین موفق به ارائه فناوری جدیدی برای زدایش نفت از دریا کردهاند. در این پژوهش در نانولایههای نیترید بور برای جذب نفت نشت یافته به دریا استفاده شده است. این نانولایهها قادرند تا ۳۳ برابر وزن خود نفت و حلالهای آلی جذب کنند که یک گام بزرگ در مسیر رفع مشکل هزینه نشت تصادفی نفت به دریا محسوب میشود.
این ماده که میتواند نفت و روغن را مانند یک اسفنج جمعآوری کند، ماحصل پروژهای است که توسط انجمن تحقیقات استرالیا مورد حمایت قرار گرفته است. این پروژه به مدت دو سال در آزمایشگاهی در موسسه مواد پیشگام در دانشگاه دکین مورد بررسی قرار گرفته است. نتایج این پروژه نیز در قالب مقالهای در نشریه Nature Communications منتشر شده است.
چین از محققان این پروژه میگوید: «نشت نفت یک مشکل جهانی بوده که اکوسیستم ما را تهدید میکند. نفتی که از نفتکشها یا دیگر حملکنندهها وارد دریا میشود میتواند هزینههای سنگینی به ما تحمیل کند.»
انجمن تحقیقات استرالیا از توسعه این نانوورق نیترید بور حمایت میکند دلیل این امر آن است که روشهای رایج بسیار کند و هزینهبر است بنابراین با این روش، ارزان و ساده میتوان نفت را جمعآوری کرد.
این نانوورقها که ضخامتی در حد چند نانومتر دارند از حفرههای بسیاری برخوردار هستند بنابراین مساحت سطح قابل توجهی داشته به طوری که یک گرم از آن میتواند به اندازه ۵ و نیم زمین تنیس مساحت داشته باشد.
به گفته محققان این پروژه، تبدیل این پودر به یک اسفنج کار بسیار دشواری است اما برای استفاده تجاری از آن، اسفنجسازی یک فرآیند ضروری است.
این گروه تحقیقاتی از روش مکانیکی- شیمیایی برای تولید محلول کلوئیدی صفحههای نیترید بور استفاده کردند و سپس آن را به یک آئروژل بسیار متخلخل تبدیل کردند. این غشاء قادر به جذب مقادیر بسیار زیادی از روغن و نفت است. پیش از انجام این کار، محققان با انجام شبیهسازی، امکان انجام این فرآیند را مورد بررسی قرار دادند.
برچسبها: آئروژل نیترید, نفت, حلال آلی, آب
زمین بی خدا ، کتابی پر از تلخی ها و حتی شیرینی های عشق
پر از کنایه و دردنامه ...
جنگ دیروز یا صلح امروز چه فرقی میکند ؟
وقتی که تاریخ من پر از نبودن های توست !!!



مجموعه عملیاتی که تحت شرایط مشخص میان نشاندهی یک دستگاه یا سیستم اندازهگیری یا مقدار یک سنجه مادی یا ماده مرجع و مقدار متناظر آن که از استانداردهای اندازهگیری حاصل میشود، رابطهای برقرار میکند.
کالیبراسیون اجازه میدهد که میزان تصحیح لازم را نسبت به نشاندهی تعیین کنیم. با کالیبراسیون ممکن است خواص اندازه شناختی دیگری نظیر اثر کمیتهای تاثیر گذار نیز تعیین شود. در واقع کالیبراسیون ویژگیهای کارآمدی دستگاه یا مواد مرجع را بوسیله انجام مقایسات مستقیم مشخص میکند.
کالیبراسیون در واقع ایجاد نظامی موثر به منظور کنترل صحت و دقت پارامترهای مترولوژیکی دستگاههای آزمون و وسایل اندازهگیری و کلیه تجهیزاتی است که عملکرد آنها بر کیفیت فرایند تاثیر گذار میباشد که به منظور اطمینان از تطابق اندازهگیریهای انجام شده با استانداردهای جهانی مورد استفاده قرار میگیرد.
کدام دستگاهها باید کالیبره شوند؟
هر وسیلهای که برای اندازهگیری به کار میرود و در روشهای اجرایی به استفاده از آن اشاره شده است، نیاز به تعیین صحت و دقت یا کالیبراسیون دارد.
دستگاههای اندازهگیری باید به طور دورهای کالیبره شوند. گذشت زمان، فرسودگی، حوادث غیر قابل پیشبینی، باعث میشوند تا قابلیت ردیابی نتایج آنها تا استانداردها زیر سوال رفته و نیازمند تایید مجدد باشند. برای تجهیزات کالیبره شده گواهی کالیبراسیون صادر شده و ضمیمه دستگاه میگردد.
کالیبره کردن تمام تجهیزات لازم نیست. برخی از آنها ممکن است صرفاً به عنوان نشان دهنده مورد استفاده قرار گیرند. انواع دیگر تجهیزات ممکن است به عنوان ابزار تشخیصی و آشکارسازی به کار بروند. هر گاه وسیلهای برای تعیین قابلیت پذیرش محصول و یا عوامل موثر در فرایند آزمون مورد استفاده قرار نگیرد کالیبراسیون آن ضرورت ندارد.
اهداف اصلی کالیبراسیون
1- برای اطمینان از قرائتهایی که از دستگاه صورت میگیرد.
2- برای تعیین درستی مقادیر خوانده شده از دستگاه.
3- برای استقرار قابلیت ردیابی دستگاه به استانداردهای مرجع (هدف نهایی کالیبراسیون برقراری قابلیت ردیابی عنوان شده است.)
قابلیت ردیابی (Traceability)
مهمترین ویژگی که یک اندازهگیری باید داشته باشد وجود قابلیت ردیابی نتایج آن تا استانداردهای ملی و سپس بین المللی میباشد.
وقتی سطح اطمینان و عدم قطعیت کلیه اندازهگیریها بیان شود درستی و دقت نتایج اندازهگیری تضمین میگردد.
قابلیت ردیابی قابلیت ارتباط دادن مقدار یک استاندارد یا نتیجه یک اندازهگیری با مرجعهای ملی یا بینالمللی از طریق زنجیره پیوسته مقایسهها که همگی عدم قطعیتی معین دارند. کالیبراسیون تنها راه برقراری قابلیت ردیابی میباشد.
دستاوردهای کالیبراسیون
• به دست آوردن نتایج درست و صحیح در اندازهگیری؛
• کاهش هزینه و دوباره کاری؛
• بهرهوری بیشتر؛
• جوابگویی در دعاوی حقیقی و حقوقی؛
• یکی از نیازهای اخذ گواهیهای استانداردهای مدیریت؛
• جلوگیری از تضییع حقوق مصرف کننده و تولید کننده؛
مراحل انجام کالیبراسیون
1. کد گذاری تجهیزات اندازهگیری و تهیه شناسنامه و لیست آنها؛
2. طبقهبندی تجهیزات اندازهگیری از نظر کالیبراسیون؛
3. تعیین دوره تناوب کالیبراسیون؛
4. تعیین حد مجاز خطا؛
5. انتخاب کالیبره کننده؛
6. کالیبراسیون (عملیات کالیبراسیون، تعیین خطای تجهیز، صدور گواهی و برچسب کالیبراسیون، نصب برچسب کالیبراسیون)؛
7. اعمال نتایج کالیبراسیون؛
8. ثبت و حفظ و نگهداری سوابق کالیبراسیون.
برچسبها: کالیبراسیون چیست, کالیبراسیون, calibration
الکترونگاتیوی الکترونگاتیویته Electronegativity میزان توانایی نسبی یک اتم در یک مولکول برای جذب جفت الکترون پیوندی بسوی خود است.
الکترونگاتیوی اتمها
اتم وقتی در لایه ظرفیت خود الکترون کمتری داشته باشد تمایلش به گرفتن و یا دادن الکترون بیشتر میشود. هرچه عنصری تمایل بیشتری به گرفتن الکترون داشته باشد الکترونگاتیوتر است.
اگرچه الکترونگاتیویته، قطبیت پیوندهای شیمیایی بین اتمهای یک مولکول را تعیین میکند اما عامل تعیین کننده قطبیت کلی مولکول نیست چون مولکول میتواند دارای مرکز تقارن باشد. در این حالت قطبیت پیوندها نسبت به هم به گونهای خنثی میشود که قطبیت کلی مولکول را صفر در نظر میگیرند. بنابراین در مولکول هایی که فاقد مرکز تقارن مولکولی هستند میتوان قطبیت کلی مولکول را با تعیین جهت بردار ممان دو قطبی در آنها نتیجه گرفت.

نسبی بودن الکترونگاتیوی
الکترونگاتیوی بایک مقیاس نسبی سنجیده میشود. دراین مقیاس برای اجتناب از درج اعداد منفی، به اتم فلوئور به عنوان الکترونگاتیوترین عنصر، الکترونگاتیوی ۴ نسبت داده شده است و مقادیر الکترونگاتیوی برای عنصرهای دیگر نسبت به این مقدار محاسبه میشود. در این محاسبات، گازهای نجیب را در نظر نمیگیرند، زیرا این عناصر به تعداد کافی ترکیبهای شیمیایی تشکیل نمیدهند. به طور کلی مقادیر الکترونگاتیوی در یک گروه از عناصراز بالا به پایین کاهش و در یک دوره از جدول تناوبی از چپ به راست افزایش مییابد. بنابراین کمترین مقدار الکترونگاتیوی را میتوان سزیم در پایین و سمت چپ جدول و بیشترین مقدار الکترونگاتیوی (با چشم پوشی از گازهای نجیب) را به اتم فلوئور در بالا و سمت راست جدول نسبت داد.
متداولترین مقیاس الکترونگاتیویته
مقیاس نسبی الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی б+ و б- اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق б و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد. در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد ۴ نسبت داده شده است.
مقیاس الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوند است. مثلا انرژی پیوند Br-Br ، انرژی لازم برای تفکیک مولکول Br2 به اتمهای Br است. برای تفکیک یک مول از مولکولهای Br2 به اندازه ۴۶+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر ۱۰۴+ کیلو کالری بر مول است.
تعاریف مختلف الکترونگاتیویته
الکترونگاتیویته ، در روشهای متفاوتی تعریف شده است که برخی از آنها به اختصار توضیح داده میشود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B میتواند به حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B بطور قابل ملاحظه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد، میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد
الکترونگاتیویته آلرد_روکر در این تعریف ، الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس میکند. بر طبق این تعریف ، عناصری با الکترونگاتیویته بالا آنهایی هستند که با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک ، این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توزیع دوباره الکترون در طی تشکیل تر کیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
اگر یک اتم دارای انرژی یونیزاسیون بالا و الکترونخواهی بالا باشد، احتمالا در هنگام تشکیل پیوند ، الکترونها را به سوی خود میکشد. بنابراین بعنوان الکترونگاتیو شناخته میشود. از طرف دیگر اگر انرژی یونش و الکترونخواهی آن ، هر دو کوچک باشد تمایل دارد تا الکترون از دست بدهد. بنابراین به عنوان الکترو پوزیتیو طبقه بندی میشود.
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی میکند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و همچنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد. فلزات ، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آنها حاکم است، ولی نافلزات ، به استثنای گازهای نجیب ، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آنها زیاد است.
بطور کلی ، الکترونگاتیوی عناصر در هر دوره از چپ به راست (با افزایش تعداد الکترونهای والانس) و در هر گروه از پایین به بالا (با کاهش اندازه اتم) افزایش مییابد. بنابراین ، الکترونگاتیوترین عناصر ، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات ، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی همجهت است.
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است، ولی دقیق نیست. روشی ساده و مستقم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روشهای گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتمهای متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم نامتغیر نیست.
انتظار میرود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از اینرو ، این مفهوم را تنها بایستی نیمهکمی تلقی کرد. بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی میشود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آنها خیلی زیاد نباشد. در اینگونه موارد، اختلاف الکترونگاتیوی عناصر نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است. اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند اساسا غیر قطبی است و اتمهای مربوط ، سهم مساوی یا تقریبا مساوی در الکترونهای پیوند دارند.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که HF قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل میشود، پیوند فلزی و در آن اختلاف الکترونگاتیوی نسبتا کم است.
کاربردهای الکترونگاتیویته
میتوان برای تعیین میزان واکنش پذیری فلزات و غیر فلزات بکار برد.
میتوان برای پیشبینی خصلت پیوندهای یک ترکیب بکار برد. هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود ۱٫۷ باشد، خصلت یونی نسبی پیوند بیش از ۵۰% است.
اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها ، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر ۲٫۱ است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد. بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
منابع:
برچسبها: الکترونگاتیوی, الکترونگاتیویته پاولینگ, مقیاس الکترونگاتیویته, الکترونگاتیوی اتمها
پس از چندین دهه تحقیق در سطح تئوریک، محققان موفق به کشف و ایجاد شکل جدیدی از هیدروژن شدند که پیش از این هرگز مشاهده نشده بود.
هیدروژن یکی از فراوانترین عناصر در جهان است و بیشتر سیارات عظیمالجثه منظومه شمسی از جمله خورشید از این ماده تشکیل شدهاند. همچنین تصور میشود که این ماده در هسته درونی مشتری و زحل در فشار بسیار بالا یافت شود و تشکیل همین شکل از هیدروژن است که به عنوان هدف نهایی این تحقیق قرار گرفته است.

در این تحقیق، دانشمندان موفق به ایجاد شکل فلزی و اتمی هیدروژن در فشار بیش از سه میلیون برابر فشار اتمسفر زمین شدند. ۳۰ سال آزمایش برای اثبات این تئوری که سابقه آن حتی به قبلتر از این زمان یعنی ۸۰ سال پیش باز میگردد، تا پیش از این به شکست منتهی شده بود.
فیزیکدانان دانشگاه ادینبورگ از یک جفت الماس به منظور فشردهسازی مولکولهای هیدروژن استفاده کردند تا به بررسی رفتار این مولکولها بپردازند. از الماس به منظور اعمال فشار بیشتر از ۳٫۵ میلیون اتمسفر استفاده و دما تا ۴۷۵ کلوین افزایش داده شد.
تحت این شرایط هیدروژن وارد فاز جامد جدیدی میشود که به نام فاز V نامگذاری شده است. در این وضعیت هیدروژن شروع به نشان دادن برخی خصوصیات جالب میکند. این مولکولها شروع به جدا شدن کرده و به اتمهای منفرد تبدیل میشوند، در حالی که الکترونهای این اتمها رفتاری شبیه به الکترونهای عناصر فلزی از خود نشان میدهند.
محققان میگویند که فاز تازه کشف شده تنها آغازی بر فرایند جداسازی مولکولی است و بر این باورند که هنوز فشارهای بالاتری برای ایجاد وضعیتهای خالص اتمی و فلزی که در تئوری پیشبینی شده مورد نیاز است.
این مطالعه در مجله Nature به چاپ رسیده است.
برچسبها: هیدروژن, حالت جدیدی هیدروژن
محققان با استفاده از نانوزیست مهندسی موفق به طراحی و ساخت یک ماده زیستی شبه ویروس شدند که تشکیل هیدروژن را به صورت ارزان و تمیز کاتالیز میکند. این ویروس مهندسی شده قادر است با هزینه کم، انرژی تولید کند.

محققان دانشگاه ایندیانا یک ماده زیستی شبه ویروس ساختند که تشکیل هیدروژن را بهصورت ارزان و تمیز کاتالیز میکند. این ماده زیستی با قرار دادن یک آنزیم اصلاح شده درون پوسته پروتئینی حفاظت کننده یک ویروس که کپسید نامیده میشود، تولید میشود. این کاتالیست «نانوراکتور» ۱۵۰ برابر کارآمدتر از نوع بدون تغییر یافته آنزیم است.
داگلاس شیمیدان دانشگاه ایندیانا میگوید: « در حقیقت، ما از توانایی ویروس برای خودآرایی دهها هزار واحد ساختمانی ژنتیک استفاده کردیم و همچنین از یک آنزیم بسیار حساس و شکننده با خصوصیت قابل ملاحظه جذب پروتونها و خارجسازی گاز هیدروژن بهره بردیم. نتیجه کار یک ذره شبه ویروس است که مشابه یک ماده بسیار پیچیده، تولید هیدروژن را کاتالیز میکند.»
برای تولید این زیستماده که با عنوان P22-Hyd شناخته میشود، تیم تحقیقاتی دو ژن از باکتری اشرییا کلی انتخاب کردند. این ژنها (hyaA و hyaB) زیرواحدهای کلیدی آنزیم هیدروژناز را رمزنگاری میکنند. در ادامه آنزیم درون کپسید حفاظتی یک ویروس باکتریایی (bacteriophage P22) تزریق میشود. استفاده از سیستم اتصال هیدروژناز و یک پوسته ویروس تنها به دلیل کارآمدتر بودن در کاتالیز تولید هیدروژن نیست، بلکه سادگی تولید چنین سیستمی (که تنها نیازمند یک فرآیند تخمیر ساده است)، نیز یکی دیگر از علتهای استفاده از این سیستم است. همچنین در مقایسه با دیگر کاتالیستها همچون پلاتین، این سیستم ارزانقیمت و سازگار با محیط زیست است.
داگلاس میافزاید: «این ماده قابل مقایسه با پلاتین است، ضمن اینکه کاملاً قابل تجدید است. شما برای تهیه آن نیاز به حفر معدن و استخراج آن ندارید، شما میتوانید آن را در دمای اتاق در مقیاس بزرگ توسط یک فناوری تخمیر تهیه کنید این ماده زیست تخریبپذیر است. این روش یک روش کاملاً سبز برای ساخت یک ماده بسیار با ارزش است.»
علاوه بر شکستن پیوندهای شیمیایی آب برای تولید هیدروژن، P22-Hyd همچنین واکنش ترکیب هیدروژن و اکسیژن برای تولید انرژی را نیز کاتالیز میکند.
محققان از یک فرم هیدروژناز (NiFe، نیتروژن-آهن) استفاده کردند که به راحتی با مواد زیستی ادغام میشود. آنزیم در فرم تغییر یافته و محافظت شده در مقایسه با فرم بدون تغییر آنزیم به دلیل پایداری بیشتر در برابر حرارت و مواد شیمیایی موجود در محیط، بسیار قویتر است.
داگلاس میگوید: «تاکنون هیچکس موفق به تولید مقدار کافی از این آنزیم برای تولید سوخت زیستی نشده است اما اکنون ما روشی را ابداع کردهایم که با استفاده از آن قادر به تولید مقادیر بالای مواد هستیم.»
نتایج این تحقیق در Nature Chemistry چاپ شده است.
برچسبها: ویروسی, نانوراکتور, هیدروژن
محققان روش جدیدی برای تبدیل گاز دی اکسید کربن به یک سوخت ساده و پاک معرفی کردهاند.
گروهی از محققان چینی ماده جدیدی تولید کردهاند که میتواند گاز دی اکسید کربن را به سوخت ساده و پاکی که formate نام گرفته تبدیل کند. در این پروسه از فرآیند کاهش الکتریکی استفاده میشود و به هیچ چیز به جز جریان متوسط برق نیاز ندارد.
ماده جدید یک مخلوط چهار اتمی از فلز کبالت و مولکولهای کبالت-اکسیژن است.
چندین دهه است که محققان به دنبال مادهای هستند که بتواند به طور الکتریکی دی اکسید کربن را کاتالیز کرده و به سوختهای مختلف تبدیل کند، اما این مواد همگی یک مشکل مشابه داشتهاند که درست کردن آنها را در آزمایشگاه غیرممکن میکرد.
روش کار این ماده در سطح مولکولی نسبتا ساده است. وقتی جریان الکتریکی برقرار میشود، این ماده با مولکولهای دی اکسید کربن که از خلال آن عبور میکنند واکنش میدهد. یک اتم هیدروژن که دارای یک الکترون و یک پروتون است، به اتم کربن مولکول دی اکسید کربن متصل میشود. وقتی این امر رخ میدهد یک الکترون اضافی به اتمهای اکسیژن در دی اکسید کربن متصل میشود و به این ترتیب CO2 به CHOO یا formate تبدیل میشود.
هم اکنون محققان به دنبال تجاریسازی این ماده جدید هستند که میتواند CO2 جمعآوری شده از نیروگاههای برق را به سوخت مناسب و پاک تبدیل کند.
محققان میگویند مطمئنا قبل از این که این فرآیند در قالب تجاری وارد چرخه عمل شود، سالها باید مورد بررسی و تحقیق قرار گیرد، اما در این مرحله که امکانپذیر بودن این پروسه به اثبات رسیده میتوان آن را پیشرفت بسیار مثبتی ارزیابی کرد.
محققان در این باره بسیار خوشبینانه هستند و میگویند ۱۰ سال پیش این که دی اکسید کربن بتواند به ماده سوختی قابل استفادهای تبدیل شود غیر ممکن به نظر میرسید، اما حالا به نظر میرسد که این فرایند عملی شده و در آینده میتواند در کاهش گرمایش جهانی تا حدودی موثر باشد.
این مقاله به تازگی در مجله Nature به چاپ رسیده است.
برچسبها: گاز دی اکسید کربن, سوخت پاک, ماده جدید
محققان با استفاده از نانوورقهای نیترید بور اقدام به تولید آئروژلی کردند که از آن میتوان برای زدایش نفت و حلالهای آلی از آب استفاده کرد.
محققان دانشگاه درکسل با همکاری پژوهشگران استرالیایی دانشگاه دکین موفق به ارائه فناوری جدیدی برای زدایش نفت از دریا کردهاند. در این پژوهش در نانولایههای نیترید بور برای جذب نفت نشت یافته به دریا استفاده شده است. این نانولایهها قادرند تا ۳۳ برابر وزن خود نفت و حلالهای آلی جذب کنند که یک گام بزرگ در مسیر رفع مشکل هزینه نشت تصادفی نفت به دریا محسوب میشود.
این ماده که میتواند نفت و روغن را مانند یک اسفنج جمعآوری کند، ماحصل پروژهای است که توسط انجمن تحقیقات استرالیا مورد حمایت قرار گرفته است. این پروژه به مدت دو سال در آزمایشگاهی در موسسه مواد پیشگام در دانشگاه دکین مورد بررسی قرار گرفته است. نتایج این پروژه نیز در قالب مقالهای در نشریه Nature Communications منتشر شده است.
چین از محققان این پروژه میگوید: «نشت نفت یک مشکل جهانی بوده که اکوسیستم ما را تهدید میکند. نفتی که از نفتکشها یا دیگر حملکنندهها وارد دریا میشود میتواند هزینههای سنگینی به ما تحمیل کند.»
انجمن تحقیقات استرالیا از توسعه این نانوورق نیترید بور حمایت میکند دلیل این امر آن است که روشهای رایج بسیار کند و هزینهبر است بنابراین با این روش، ارزان و ساده میتوان نفت را جمعآوری کرد.
این نانوورقها که ضخامتی در حد چند نانومتر دارند از حفرههای بسیاری برخوردار هستند بنابراین مساحت سطح قابل توجهی داشته به طوری که یک گرم از آن میتواند به اندازه ۵ و نیم زمین تنیس مساحت داشته باشد.
به گفته محققان این پروژه، تبدیل این پودر به یک اسفنج کار بسیار دشواری است اما برای استفاده تجاری از آن، اسفنجسازی یک فرآیند ضروری است.
این گروه تحقیقاتی از روش مکانیکی- شیمیایی برای تولید محلول کلوئیدی صفحههای نیترید بور استفاده کردند و سپس آن را به یک آئروژل بسیار متخلخل تبدیل کردند. این غشاء قادر به جذب مقادیر بسیار زیادی از روغن و نفت است. پیش از انجام این کار، محققان با انجام شبیهسازی، امکان انجام این فرآیند را مورد بررسی قرار دادند.
برچسبها: آئروژل نیترید, نفت, حلال آلی, آب
زمین بی خدا ، کتابی پر از تلخی ها و حتی شیرینی های عشق
پر از کنایه و دردنامه ...
جنگ دیروز یا صلح امروز چه فرقی میکند ؟
وقتی که تاریخ من پر از نبودن های توست !!!



مجموعه عملیاتی که تحت شرایط مشخص میان نشاندهی یک دستگاه یا سیستم اندازهگیری یا مقدار یک سنجه مادی یا ماده مرجع و مقدار متناظر آن که از استانداردهای اندازهگیری حاصل میشود، رابطهای برقرار میکند.
کالیبراسیون اجازه میدهد که میزان تصحیح لازم را نسبت به نشاندهی تعیین کنیم. با کالیبراسیون ممکن است خواص اندازه شناختی دیگری نظیر اثر کمیتهای تاثیر گذار نیز تعیین شود. در واقع کالیبراسیون ویژگیهای کارآمدی دستگاه یا مواد مرجع را بوسیله انجام مقایسات مستقیم مشخص میکند.
کالیبراسیون در واقع ایجاد نظامی موثر به منظور کنترل صحت و دقت پارامترهای مترولوژیکی دستگاههای آزمون و وسایل اندازهگیری و کلیه تجهیزاتی است که عملکرد آنها بر کیفیت فرایند تاثیر گذار میباشد که به منظور اطمینان از تطابق اندازهگیریهای انجام شده با استانداردهای جهانی مورد استفاده قرار میگیرد.
کدام دستگاهها باید کالیبره شوند؟
هر وسیلهای که برای اندازهگیری به کار میرود و در روشهای اجرایی به استفاده از آن اشاره شده است، نیاز به تعیین صحت و دقت یا کالیبراسیون دارد.
دستگاههای اندازهگیری باید به طور دورهای کالیبره شوند. گذشت زمان، فرسودگی، حوادث غیر قابل پیشبینی، باعث میشوند تا قابلیت ردیابی نتایج آنها تا استانداردها زیر سوال رفته و نیازمند تایید مجدد باشند. برای تجهیزات کالیبره شده گواهی کالیبراسیون صادر شده و ضمیمه دستگاه میگردد.
کالیبره کردن تمام تجهیزات لازم نیست. برخی از آنها ممکن است صرفاً به عنوان نشان دهنده مورد استفاده قرار گیرند. انواع دیگر تجهیزات ممکن است به عنوان ابزار تشخیصی و آشکارسازی به کار بروند. هر گاه وسیلهای برای تعیین قابلیت پذیرش محصول و یا عوامل موثر در فرایند آزمون مورد استفاده قرار نگیرد کالیبراسیون آن ضرورت ندارد.
اهداف اصلی کالیبراسیون
1- برای اطمینان از قرائتهایی که از دستگاه صورت میگیرد.
2- برای تعیین درستی مقادیر خوانده شده از دستگاه.
3- برای استقرار قابلیت ردیابی دستگاه به استانداردهای مرجع (هدف نهایی کالیبراسیون برقراری قابلیت ردیابی عنوان شده است.)
قابلیت ردیابی (Traceability)
مهمترین ویژگی که یک اندازهگیری باید داشته باشد وجود قابلیت ردیابی نتایج آن تا استانداردهای ملی و سپس بین المللی میباشد.
وقتی سطح اطمینان و عدم قطعیت کلیه اندازهگیریها بیان شود درستی و دقت نتایج اندازهگیری تضمین میگردد.
قابلیت ردیابی قابلیت ارتباط دادن مقدار یک استاندارد یا نتیجه یک اندازهگیری با مرجعهای ملی یا بینالمللی از طریق زنجیره پیوسته مقایسهها که همگی عدم قطعیتی معین دارند. کالیبراسیون تنها راه برقراری قابلیت ردیابی میباشد.
دستاوردهای کالیبراسیون
• به دست آوردن نتایج درست و صحیح در اندازهگیری؛
• کاهش هزینه و دوباره کاری؛
• بهرهوری بیشتر؛
• جوابگویی در دعاوی حقیقی و حقوقی؛
• یکی از نیازهای اخذ گواهیهای استانداردهای مدیریت؛
• جلوگیری از تضییع حقوق مصرف کننده و تولید کننده؛
مراحل انجام کالیبراسیون
1. کد گذاری تجهیزات اندازهگیری و تهیه شناسنامه و لیست آنها؛
2. طبقهبندی تجهیزات اندازهگیری از نظر کالیبراسیون؛
3. تعیین دوره تناوب کالیبراسیون؛
4. تعیین حد مجاز خطا؛
5. انتخاب کالیبره کننده؛
6. کالیبراسیون (عملیات کالیبراسیون، تعیین خطای تجهیز، صدور گواهی و برچسب کالیبراسیون، نصب برچسب کالیبراسیون)؛
7. اعمال نتایج کالیبراسیون؛
8. ثبت و حفظ و نگهداری سوابق کالیبراسیون.
برچسبها: کالیبراسیون چیست, کالیبراسیون, calibration
الکترونگاتیوی الکترونگاتیویته Electronegativity میزان توانایی نسبی یک اتم در یک مولکول برای جذب جفت الکترون پیوندی بسوی خود است.
الکترونگاتیوی اتمها
اتم وقتی در لایه ظرفیت خود الکترون کمتری داشته باشد تمایلش به گرفتن و یا دادن الکترون بیشتر میشود. هرچه عنصری تمایل بیشتری به گرفتن الکترون داشته باشد الکترونگاتیوتر است.
اگرچه الکترونگاتیویته، قطبیت پیوندهای شیمیایی بین اتمهای یک مولکول را تعیین میکند اما عامل تعیین کننده قطبیت کلی مولکول نیست چون مولکول میتواند دارای مرکز تقارن باشد. در این حالت قطبیت پیوندها نسبت به هم به گونهای خنثی میشود که قطبیت کلی مولکول را صفر در نظر میگیرند. بنابراین در مولکول هایی که فاقد مرکز تقارن مولکولی هستند میتوان قطبیت کلی مولکول را با تعیین جهت بردار ممان دو قطبی در آنها نتیجه گرفت.

نسبی بودن الکترونگاتیوی
الکترونگاتیوی بایک مقیاس نسبی سنجیده میشود. دراین مقیاس برای اجتناب از درج اعداد منفی، به اتم فلوئور به عنوان الکترونگاتیوترین عنصر، الکترونگاتیوی ۴ نسبت داده شده است و مقادیر الکترونگاتیوی برای عنصرهای دیگر نسبت به این مقدار محاسبه میشود. در این محاسبات، گازهای نجیب را در نظر نمیگیرند، زیرا این عناصر به تعداد کافی ترکیبهای شیمیایی تشکیل نمیدهند. به طور کلی مقادیر الکترونگاتیوی در یک گروه از عناصراز بالا به پایین کاهش و در یک دوره از جدول تناوبی از چپ به راست افزایش مییابد. بنابراین کمترین مقدار الکترونگاتیوی را میتوان سزیم در پایین و سمت چپ جدول و بیشترین مقدار الکترونگاتیوی (با چشم پوشی از گازهای نجیب) را به اتم فلوئور در بالا و سمت راست جدول نسبت داد.
متداولترین مقیاس الکترونگاتیویته
مقیاس نسبی الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی б+ و б- اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق б و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد. در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد ۴ نسبت داده شده است.
مقیاس الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوند است. مثلا انرژی پیوند Br-Br ، انرژی لازم برای تفکیک مولکول Br2 به اتمهای Br است. برای تفکیک یک مول از مولکولهای Br2 به اندازه ۴۶+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر ۱۰۴+ کیلو کالری بر مول است.
تعاریف مختلف الکترونگاتیویته
الکترونگاتیویته ، در روشهای متفاوتی تعریف شده است که برخی از آنها به اختصار توضیح داده میشود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B میتواند به حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B بطور قابل ملاحظه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد، میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد
الکترونگاتیویته آلرد_روکر در این تعریف ، الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس میکند. بر طبق این تعریف ، عناصری با الکترونگاتیویته بالا آنهایی هستند که با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک ، این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توزیع دوباره الکترون در طی تشکیل تر کیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
اگر یک اتم دارای انرژی یونیزاسیون بالا و الکترونخواهی بالا باشد، احتمالا در هنگام تشکیل پیوند ، الکترونها را به سوی خود میکشد. بنابراین بعنوان الکترونگاتیو شناخته میشود. از طرف دیگر اگر انرژی یونش و الکترونخواهی آن ، هر دو کوچک باشد تمایل دارد تا الکترون از دست بدهد. بنابراین به عنوان الکترو پوزیتیو طبقه بندی میشود.
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی میکند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و همچنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد. فلزات ، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آنها حاکم است، ولی نافلزات ، به استثنای گازهای نجیب ، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آنها زیاد است.
بطور کلی ، الکترونگاتیوی عناصر در هر دوره از چپ به راست (با افزایش تعداد الکترونهای والانس) و در هر گروه از پایین به بالا (با کاهش اندازه اتم) افزایش مییابد. بنابراین ، الکترونگاتیوترین عناصر ، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات ، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی همجهت است.
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است، ولی دقیق نیست. روشی ساده و مستقم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روشهای گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتمهای متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم نامتغیر نیست.
انتظار میرود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از اینرو ، این مفهوم را تنها بایستی نیمهکمی تلقی کرد. بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی میشود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آنها خیلی زیاد نباشد. در اینگونه موارد، اختلاف الکترونگاتیوی عناصر نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است. اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند اساسا غیر قطبی است و اتمهای مربوط ، سهم مساوی یا تقریبا مساوی در الکترونهای پیوند دارند.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که HF قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل میشود، پیوند فلزی و در آن اختلاف الکترونگاتیوی نسبتا کم است.
کاربردهای الکترونگاتیویته
میتوان برای تعیین میزان واکنش پذیری فلزات و غیر فلزات بکار برد.
میتوان برای پیشبینی خصلت پیوندهای یک ترکیب بکار برد. هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود ۱٫۷ باشد، خصلت یونی نسبی پیوند بیش از ۵۰% است.
اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها ، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر ۲٫۱ است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد. بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
منابع:
برچسبها: الکترونگاتیوی, الکترونگاتیویته پاولینگ, مقیاس الکترونگاتیویته, الکترونگاتیوی اتمها
پس از چندین دهه تحقیق در سطح تئوریک، محققان موفق به کشف و ایجاد شکل جدیدی از هیدروژن شدند که پیش از این هرگز مشاهده نشده بود.
هیدروژن یکی از فراوانترین عناصر در جهان است و بیشتر سیارات عظیمالجثه منظومه شمسی از جمله خورشید از این ماده تشکیل شدهاند. همچنین تصور میشود که این ماده در هسته درونی مشتری و زحل در فشار بسیار بالا یافت شود و تشکیل همین شکل از هیدروژن است که به عنوان هدف نهایی این تحقیق قرار گرفته است.

در این تحقیق، دانشمندان موفق به ایجاد شکل فلزی و اتمی هیدروژن در فشار بیش از سه میلیون برابر فشار اتمسفر زمین شدند. ۳۰ سال آزمایش برای اثبات این تئوری که سابقه آن حتی به قبلتر از این زمان یعنی ۸۰ سال پیش باز میگردد، تا پیش از این به شکست منتهی شده بود.
فیزیکدانان دانشگاه ادینبورگ از یک جفت الماس به منظور فشردهسازی مولکولهای هیدروژن استفاده کردند تا به بررسی رفتار این مولکولها بپردازند. از الماس به منظور اعمال فشار بیشتر از ۳٫۵ میلیون اتمسفر استفاده و دما تا ۴۷۵ کلوین افزایش داده شد.
تحت این شرایط هیدروژن وارد فاز جامد جدیدی میشود که به نام فاز V نامگذاری شده است. در این وضعیت هیدروژن شروع به نشان دادن برخی خصوصیات جالب میکند. این مولکولها شروع به جدا شدن کرده و به اتمهای منفرد تبدیل میشوند، در حالی که الکترونهای این اتمها رفتاری شبیه به الکترونهای عناصر فلزی از خود نشان میدهند.
محققان میگویند که فاز تازه کشف شده تنها آغازی بر فرایند جداسازی مولکولی است و بر این باورند که هنوز فشارهای بالاتری برای ایجاد وضعیتهای خالص اتمی و فلزی که در تئوری پیشبینی شده مورد نیاز است.
این مطالعه در مجله Nature به چاپ رسیده است.
برچسبها: هیدروژن, حالت جدیدی هیدروژن
محققان با استفاده از نانوزیست مهندسی موفق به طراحی و ساخت یک ماده زیستی شبه ویروس شدند که تشکیل هیدروژن را به صورت ارزان و تمیز کاتالیز میکند. این ویروس مهندسی شده قادر است با هزینه کم، انرژی تولید کند.

محققان دانشگاه ایندیانا یک ماده زیستی شبه ویروس ساختند که تشکیل هیدروژن را بهصورت ارزان و تمیز کاتالیز میکند. این ماده زیستی با قرار دادن یک آنزیم اصلاح شده درون پوسته پروتئینی حفاظت کننده یک ویروس که کپسید نامیده میشود، تولید میشود. این کاتالیست «نانوراکتور» ۱۵۰ برابر کارآمدتر از نوع بدون تغییر یافته آنزیم است.
داگلاس شیمیدان دانشگاه ایندیانا میگوید: « در حقیقت، ما از توانایی ویروس برای خودآرایی دهها هزار واحد ساختمانی ژنتیک استفاده کردیم و همچنین از یک آنزیم بسیار حساس و شکننده با خصوصیت قابل ملاحظه جذب پروتونها و خارجسازی گاز هیدروژن بهره بردیم. نتیجه کار یک ذره شبه ویروس است که مشابه یک ماده بسیار پیچیده، تولید هیدروژن را کاتالیز میکند.»
برای تولید این زیستماده که با عنوان P22-Hyd شناخته میشود، تیم تحقیقاتی دو ژن از باکتری اشرییا کلی انتخاب کردند. این ژنها (hyaA و hyaB) زیرواحدهای کلیدی آنزیم هیدروژناز را رمزنگاری میکنند. در ادامه آنزیم درون کپسید حفاظتی یک ویروس باکتریایی (bacteriophage P22) تزریق میشود. استفاده از سیستم اتصال هیدروژناز و یک پوسته ویروس تنها به دلیل کارآمدتر بودن در کاتالیز تولید هیدروژن نیست، بلکه سادگی تولید چنین سیستمی (که تنها نیازمند یک فرآیند تخمیر ساده است)، نیز یکی دیگر از علتهای استفاده از این سیستم است. همچنین در مقایسه با دیگر کاتالیستها همچون پلاتین، این سیستم ارزانقیمت و سازگار با محیط زیست است.
داگلاس میافزاید: «این ماده قابل مقایسه با پلاتین است، ضمن اینکه کاملاً قابل تجدید است. شما برای تهیه آن نیاز به حفر معدن و استخراج آن ندارید، شما میتوانید آن را در دمای اتاق در مقیاس بزرگ توسط یک فناوری تخمیر تهیه کنید این ماده زیست تخریبپذیر است. این روش یک روش کاملاً سبز برای ساخت یک ماده بسیار با ارزش است.»
علاوه بر شکستن پیوندهای شیمیایی آب برای تولید هیدروژن، P22-Hyd همچنین واکنش ترکیب هیدروژن و اکسیژن برای تولید انرژی را نیز کاتالیز میکند.
محققان از یک فرم هیدروژناز (NiFe، نیتروژن-آهن) استفاده کردند که به راحتی با مواد زیستی ادغام میشود. آنزیم در فرم تغییر یافته و محافظت شده در مقایسه با فرم بدون تغییر آنزیم به دلیل پایداری بیشتر در برابر حرارت و مواد شیمیایی موجود در محیط، بسیار قویتر است.
داگلاس میگوید: «تاکنون هیچکس موفق به تولید مقدار کافی از این آنزیم برای تولید سوخت زیستی نشده است اما اکنون ما روشی را ابداع کردهایم که با استفاده از آن قادر به تولید مقادیر بالای مواد هستیم.»
نتایج این تحقیق در Nature Chemistry چاپ شده است.
برچسبها: ویروسی, نانوراکتور, هیدروژن
محققان روش جدیدی برای تبدیل گاز دی اکسید کربن به یک سوخت ساده و پاک معرفی کردهاند.
گروهی از محققان چینی ماده جدیدی تولید کردهاند که میتواند گاز دی اکسید کربن را به سوخت ساده و پاکی که formate نام گرفته تبدیل کند. در این پروسه از فرآیند کاهش الکتریکی استفاده میشود و به هیچ چیز به جز جریان متوسط برق نیاز ندارد.
ماده جدید یک مخلوط چهار اتمی از فلز کبالت و مولکولهای کبالت-اکسیژن است.
چندین دهه است که محققان به دنبال مادهای هستند که بتواند به طور الکتریکی دی اکسید کربن را کاتالیز کرده و به سوختهای مختلف تبدیل کند، اما این مواد همگی یک مشکل مشابه داشتهاند که درست کردن آنها را در آزمایشگاه غیرممکن میکرد.
روش کار این ماده در سطح مولکولی نسبتا ساده است. وقتی جریان الکتریکی برقرار میشود، این ماده با مولکولهای دی اکسید کربن که از خلال آن عبور میکنند واکنش میدهد. یک اتم هیدروژن که دارای یک الکترون و یک پروتون است، به اتم کربن مولکول دی اکسید کربن متصل میشود. وقتی این امر رخ میدهد یک الکترون اضافی به اتمهای اکسیژن در دی اکسید کربن متصل میشود و به این ترتیب CO2 به CHOO یا formate تبدیل میشود.
هم اکنون محققان به دنبال تجاریسازی این ماده جدید هستند که میتواند CO2 جمعآوری شده از نیروگاههای برق را به سوخت مناسب و پاک تبدیل کند.
محققان میگویند مطمئنا قبل از این که این فرآیند در قالب تجاری وارد چرخه عمل شود، سالها باید مورد بررسی و تحقیق قرار گیرد، اما در این مرحله که امکانپذیر بودن این پروسه به اثبات رسیده میتوان آن را پیشرفت بسیار مثبتی ارزیابی کرد.
محققان در این باره بسیار خوشبینانه هستند و میگویند ۱۰ سال پیش این که دی اکسید کربن بتواند به ماده سوختی قابل استفادهای تبدیل شود غیر ممکن به نظر میرسید، اما حالا به نظر میرسد که این فرایند عملی شده و در آینده میتواند در کاهش گرمایش جهانی تا حدودی موثر باشد.
این مقاله به تازگی در مجله Nature به چاپ رسیده است.
برچسبها: گاز دی اکسید کربن, سوخت پاک, ماده جدید
محققان با استفاده از نانوورقهای نیترید بور اقدام به تولید آئروژلی کردند که از آن میتوان برای زدایش نفت و حلالهای آلی از آب استفاده کرد.
محققان دانشگاه درکسل با همکاری پژوهشگران استرالیایی دانشگاه دکین موفق به ارائه فناوری جدیدی برای زدایش نفت از دریا کردهاند. در این پژوهش در نانولایههای نیترید بور برای جذب نفت نشت یافته به دریا استفاده شده است. این نانولایهها قادرند تا ۳۳ برابر وزن خود نفت و حلالهای آلی جذب کنند که یک گام بزرگ در مسیر رفع مشکل هزینه نشت تصادفی نفت به دریا محسوب میشود.
این ماده که میتواند نفت و روغن را مانند یک اسفنج جمعآوری کند، ماحصل پروژهای است که توسط انجمن تحقیقات استرالیا مورد حمایت قرار گرفته است. این پروژه به مدت دو سال در آزمایشگاهی در موسسه مواد پیشگام در دانشگاه دکین مورد بررسی قرار گرفته است. نتایج این پروژه نیز در قالب مقالهای در نشریه Nature Communications منتشر شده است.
چین از محققان این پروژه میگوید: «نشت نفت یک مشکل جهانی بوده که اکوسیستم ما را تهدید میکند. نفتی که از نفتکشها یا دیگر حملکنندهها وارد دریا میشود میتواند هزینههای سنگینی به ما تحمیل کند.»
انجمن تحقیقات استرالیا از توسعه این نانوورق نیترید بور حمایت میکند دلیل این امر آن است که روشهای رایج بسیار کند و هزینهبر است بنابراین با این روش، ارزان و ساده میتوان نفت را جمعآوری کرد.
این نانوورقها که ضخامتی در حد چند نانومتر دارند از حفرههای بسیاری برخوردار هستند بنابراین مساحت سطح قابل توجهی داشته به طوری که یک گرم از آن میتواند به اندازه ۵ و نیم زمین تنیس مساحت داشته باشد.
به گفته محققان این پروژه، تبدیل این پودر به یک اسفنج کار بسیار دشواری است اما برای استفاده تجاری از آن، اسفنجسازی یک فرآیند ضروری است.
این گروه تحقیقاتی از روش مکانیکی- شیمیایی برای تولید محلول کلوئیدی صفحههای نیترید بور استفاده کردند و سپس آن را به یک آئروژل بسیار متخلخل تبدیل کردند. این غشاء قادر به جذب مقادیر بسیار زیادی از روغن و نفت است. پیش از انجام این کار، محققان با انجام شبیهسازی، امکان انجام این فرآیند را مورد بررسی قرار دادند.
برچسبها: آئروژل نیترید, نفت, حلال آلی, آب
زمین بی خدا ، کتابی پر از تلخی ها و حتی شیرینی های عشق
پر از کنایه و دردنامه ...
جنگ دیروز یا صلح امروز چه فرقی میکند ؟
وقتی که تاریخ من پر از نبودن های توست !!!



- ۹۹/۰۲/۲۱
